Bald auch in Deutschland?Erster Impfstoff gegen RS-Virus in den USA zugelassen
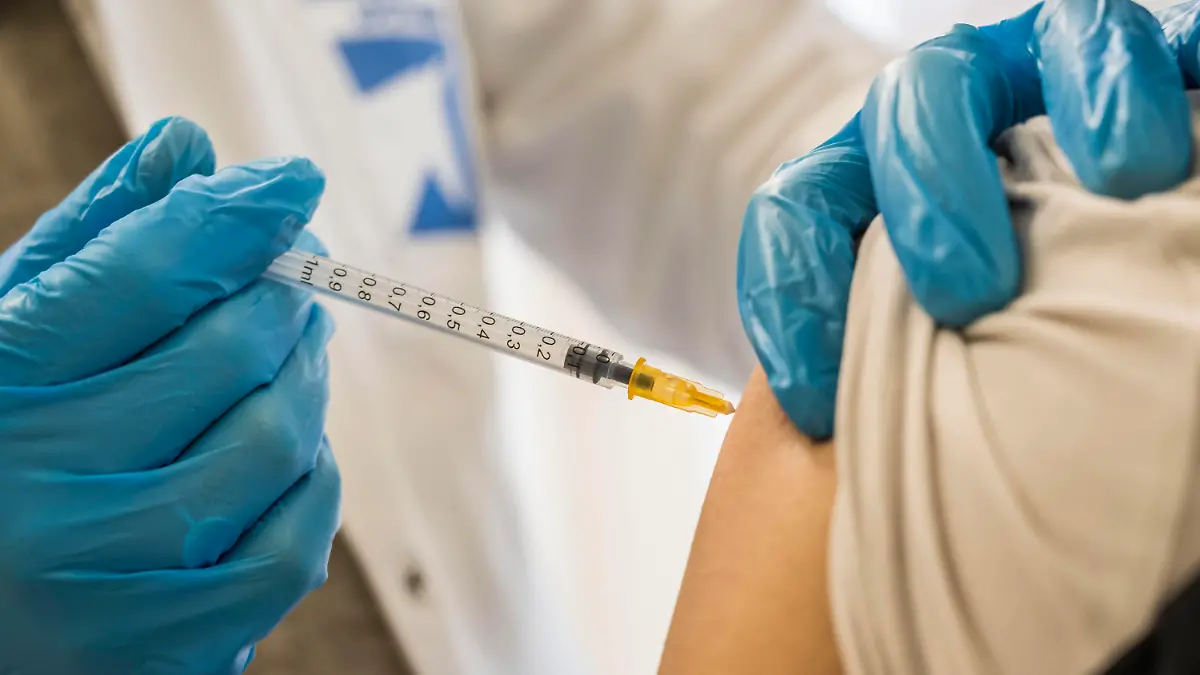
Es ist ein riesiger Durchbruch, den Forschende in den USA gerade feiern: Dort wurde nun erstmals ein Impfstoff gegen das gefährliche RS-Virus zugelassen – nach 60 Jahren Forschung! Und auch in der EU wird bereits über eine Zulassung des Impfstoffes diskutiert.
Erstmal nur für über 60-Jährige zugelassen
Der Impfstoff Arexvy des britischen Pharmakonzerns GFK soll sowohl leichten als auch schweren Erkrankungen der unteren Atemwege vorbeugen, die durch eine Infektion mit dem respiratorischen Synzytial-Virus (RSV) hervorgerufen werden. Demnach reduziere der Impfstoff das Risiko einer leichten Atemwegserkrankung um 82,6 Prozent und das Risiko einer schweren Atemwegserkrankung sogar um 94,1 Prozent, heißt es in einer Pressemitteilung der amerikanischen Arzneimittelbehörde FDA.
Allerdings ist der Impfstoff bisher nur für Personen ab 60 Jahren zugelassen. Auch wenn die Krankheit vor allem mit Babys assoziiert werde, haben auch „ältere Erwachsene, insbesondere solche mit Grunderkrankungen wie Herz- oder Lungenkrankheiten oder einem geschwächten Immunsystem“ ein hohes Risiko für schwere RSV-Erkrankungen, so die FDA.
Lese-Tipp: RSV-Welle in Deutschland: Das sind die Symptome
Der Impfstoff sei laut dem Paul-Ehrlich-Institut (PEI) genverändert und enthalte ein Protein, das dem Körper beim Bilden von Antikörpern gegen das RS-Virus helfe. Er wirke außerdem wie ein Booster für das Immunsystem.
Im Video: RSV-Infektionswelle brachte Kinderkrankenhäuser ans Limit
Die Zulassung beruht auf einer noch laufenden Studie, an der etwa 15.000 Menschen ab 60 Jahren auf der ganzen Welt teilnehmen. Da das RS-Virus saisonal auftritt, – vor allem im Herbst und im Winter, – untersuchen die Studienleiter den Impfstoff und seine Auffrischungsdosen über drei RSV-Wellen hinweg. Der Impfstoff dürfe laut der FDA auch nach mehrfachen Impfungen keine starken Nebenwirkungen hervorrufen. Bisher belaufen diese sich auf typische Grippesymptome direkt nach der Impfung – zum Beispiel Kopf- und Gliederschmerzen – bei zehn Teilnehmern trat etwa einen Monat nach der Impfung zudem ein Vorhofflimmern auf.
Lese-Tipp: RS-Virus, Corona, Grippe oder Scharlach? Wie Sie Symptome richtig deuten
Anzeige:Wie stehen Sie dazu?
Das Ergebnis dieser Umfrage ist nicht repräsentativ.
Zulassung auch in der EU diskutiert - trotz Nebenwirkungen
Allerdings verbindet die FDA die Zulassung mit einer Auflage. Denn bei zwei weiteren, älteren Studien traten nach der Impfung teils tödliche Nebenwirkungen auf. In beiden Untersuchungen wurde der Arexvy- mit einem Grippeimpfstoff kombiniert. Zwei der Studienteilnehmer entwickelten daraufhin eine akute disseminierte Enzephalomyelitis (ADEM), also eine Entzündung des zentralen Nervensystems, die unter anderem das Gehirn befällt. Einer der Betroffenen starb. Ein anderer Teilnehmer erkrankte außerdem am Guillain-Barré-Syndrom, das Lähmungen hervorrufen kann.
Die FDA fordert GFK deshalb auf, nach Markteinführung eine Studie durchzuführen, die diese Nebenwirkungen genauer untersucht.
Das PEI schreibt übrigens auf seiner Webseite, dass die europäische Arzneimittelagentur EMA den Impfstoff gerade auf eine Zulassung in der EU hin überprüft. Die EMA habe sich bereits im April positiv über den Impfstoff geäußert; am Ende entscheide jedoch die Europäische Kommission, ob Arexvy hierzulande zugelassen werde. Wann das passieren könnte, ist allerdings nicht klar. (jbü)