Medikament soll Infizierte vor schwerem Verlauf schützenCOVID-Pille "Paxlovid" - EMA prüft Zulassung in der EU

Die COVID-Pille „Paxlovid“ von Pfizer soll Patienten, die sich mit Corona-Infiziert haben und sehr wahrscheinlich einen schweren COVID-Verlauf erleben werden, Hoffnung im Kampf gegen die Krankheit geben. Früh nach einer bestätigten Corona-Infektion verabreicht, soll eine Behandlung mit „Paxlovid“ das Risiko für eine Krankenhauseinweisung drastisch verringern. Deshalb prüft die europäische Arzneimittelbehörde ob und wie das Medikament in Europa eingesetzt werden könnte. Eine Alternative zum Impfstoff ist „Paxlovid“ aber ausdrücklich nicht!
+++ Alle aktuellen Informationen zum Coronavirus finden Sie in unserem Live-Ticker auf RTL.de und rund um die Uhr im Stream auf n-tv +++
EMA prüft Einsatzmöglichkeiten
Die europäische Arzneimittelbehörde EMA hat mit einer Untersuchung des Covid-19-Medikaments Paxlovid des Herstellers Pfizer begonnen, um Ländern einen frühzeitigen Einsatz noch vor einer Marktzulassung zu ermöglichen. Dazu würden bereits vorhandene Daten von Tests mit Paxlovid bei Erkrankten mit dem Risiko eines schweren Verlaufs ausgewertet, teilte die EMA am Freitag in Amsterdam mit. Vorläufige Ergebnisse wiesen darauf hin, dass Paxlovid das Risiko einer Krankenhausbehandlung oder eines tödlichen Ausgangs einer Corona-Infektion reduziert. Untersucht würden auch Daten zur Qualität und Sicherheit des Medikaments.
 01:16
01:16Nach Lkw-Unfall geflohen! Polizisten schießen auf Affen – weil sie gefährlich sein sollen
 02:03
02:03Maskenpflicht fällt in Bus und Bahn
 01:31
01:31NRW: Maskenpflicht entfällt in Bus und Bahn
 01:31
01:31Corona heute seit drei Jahren in Deutschland
 01:36
01:36Corona rum, aber Maske bleibt? Hier gilt die Maskenpflicht
 01:40
01:40Streeck warnt vor vielen Infektionen im Herbst
 01:26
01:26Corona-Fallzahlen in Deutschland steigen rasant an
 03:47
03:47Weiterhin ansteckend trotz negativem Test?
 03:47
03:47Weiterhin ansteckend trotz negativem Test?
 03:00
03:00Zweimal Novavax : Welcher Booster kommt für mich in Frage?
 01:48
01:48Weltärzte-Chef kritisiert Quarantäne-Hickhack
 04:25
04:25Keine neuen Corona-Varianten mehr trotz hoher Inzidenzen?
 01:41
01:41Fällt die Maske zu früh?
 04:44
04:44Geimpft, Geboostert, Genesen: Wie hoch ist der Immunschutz?
 04:07
04:07Muss ich mich nach Quarantäne an Hygienemaßnahmen halten?
 00:35
00:35Viele Schnelltests versagen bei Omikron-Früherkennung
 02:50
02:50Gute Aussichten auf den Sommer trotz neuer Variante BA.2?
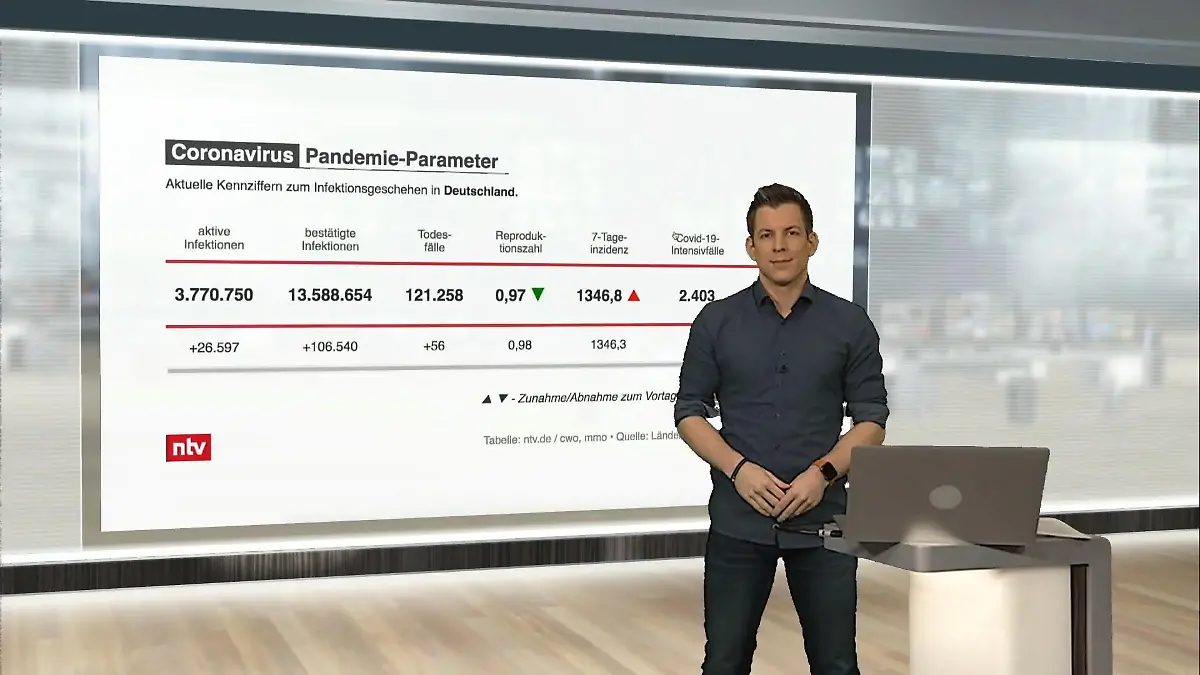 03:51
03:51Die aktuellen Corona-Zahlen für Deutschland
 02:05
02:05Angst vor Long Covid
 04:37
04:37Vierte Impfung: Welcher Impfstoff ist der beste?
 04:15
04:15Sterblichkeitsrate in Deutschland viel höher als in Dänemark
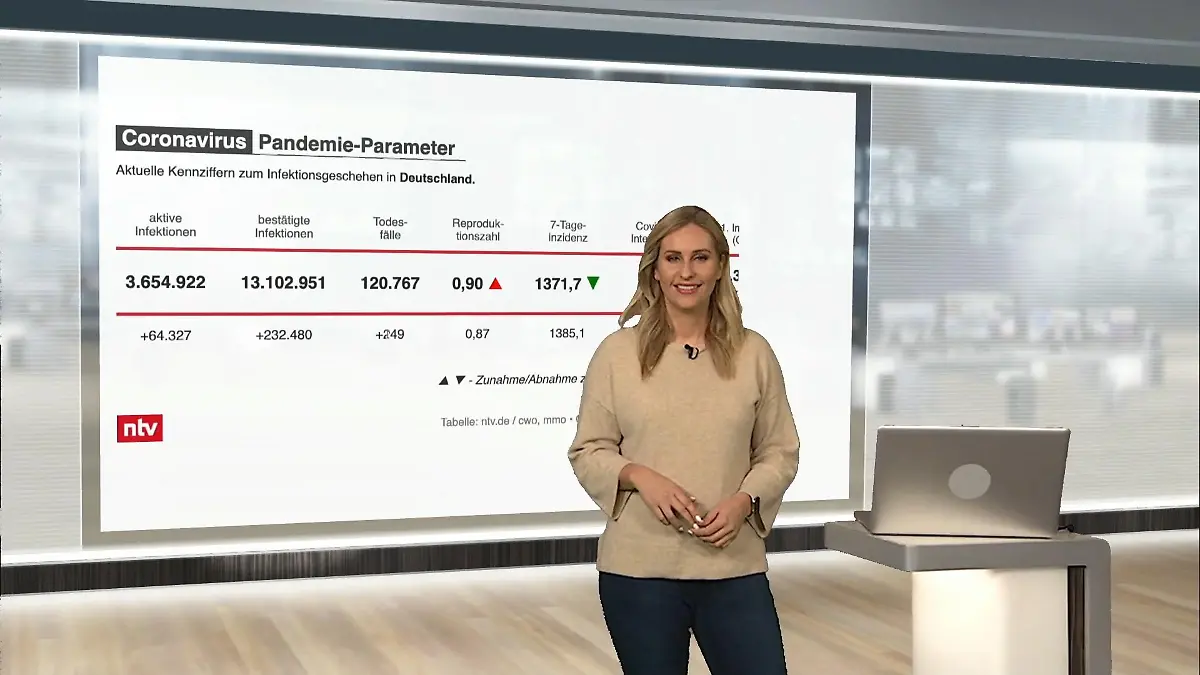 04:26
04:26Die aktuellen Zahlen am Freitag
 01:47
01:47"Man kann keinen Corona-Exit beschließen"
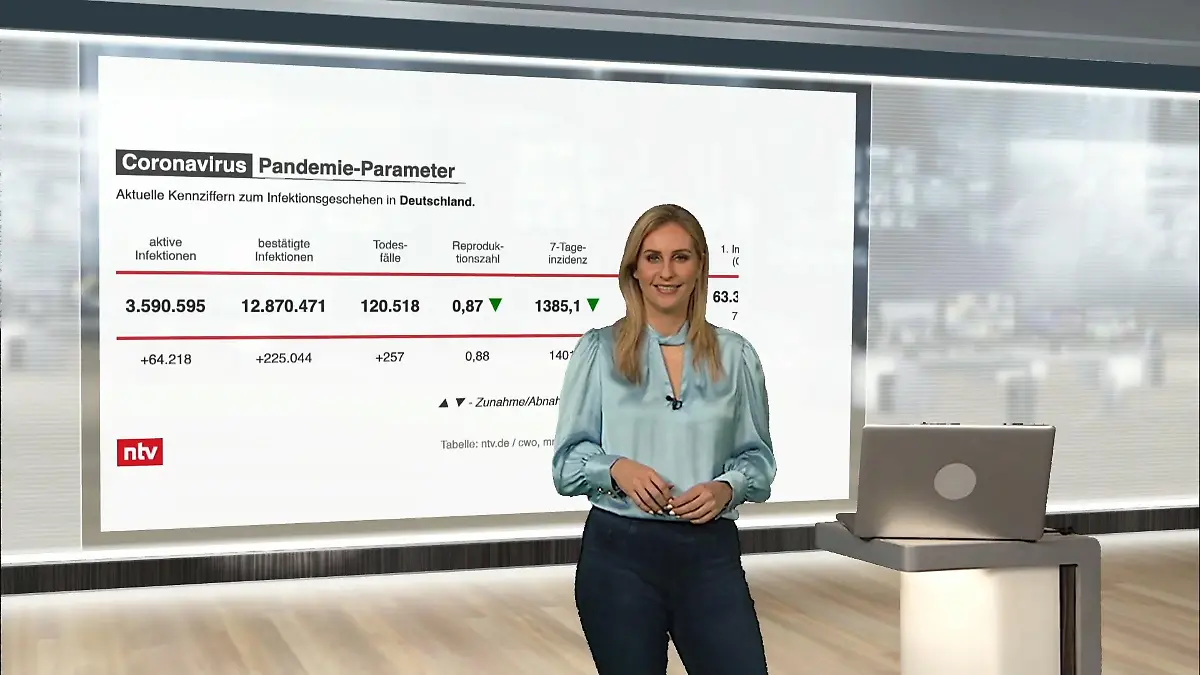 03:16
03:16Die aktuellen Corona-Zahlen für Deutschland
 00:41
00:41Brauchen allgemeine Impfpflicht für Herbst & Winter
 01:32
01:32Scholz: Haben uns Lockerungen verdient
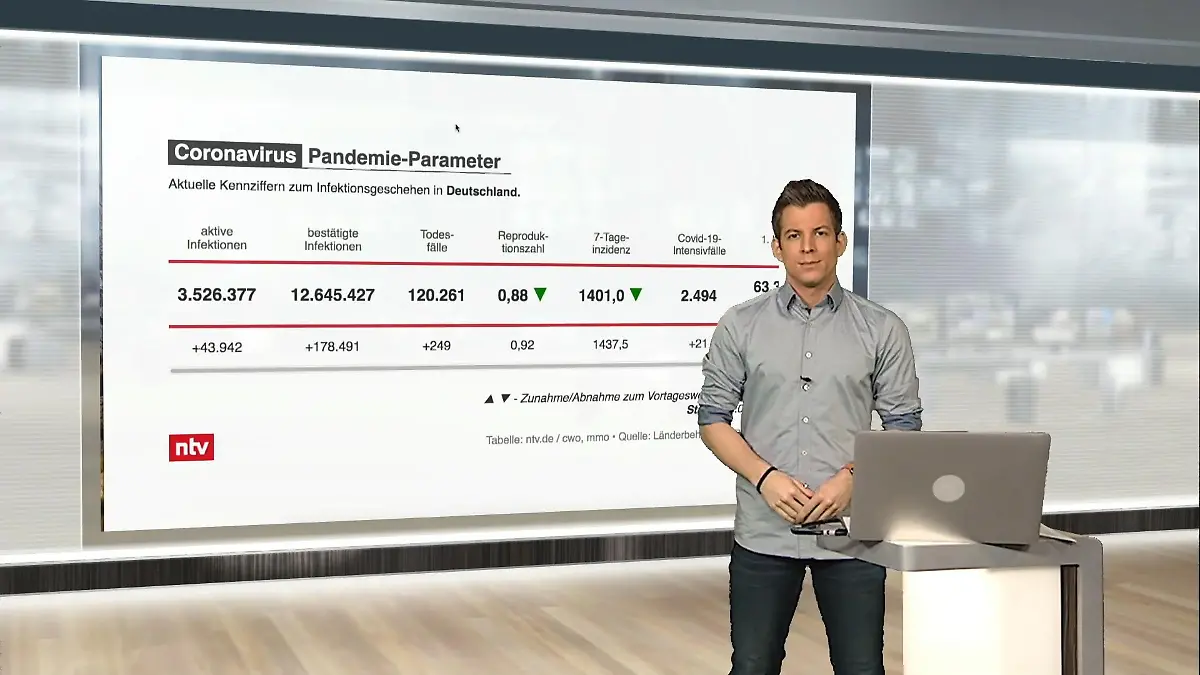 03:53
03:53Das sind die aktuellen Coronazahlen für Deutschland
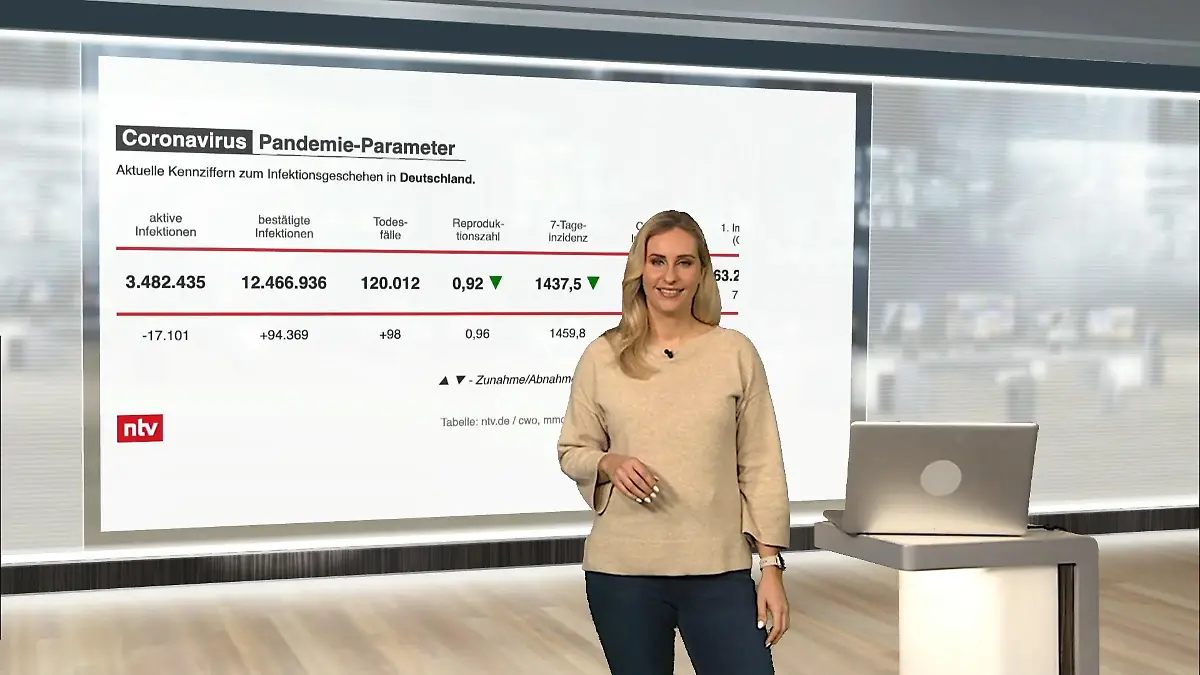 04:05
04:05Die aktuellen Corona-Zahlen für Deutschland
 03:16
03:16Bund und Länder diskutieren Lockerungen: Bald Normalität?
 02:17
02:17Maskenpflicht adé ab Sommer?
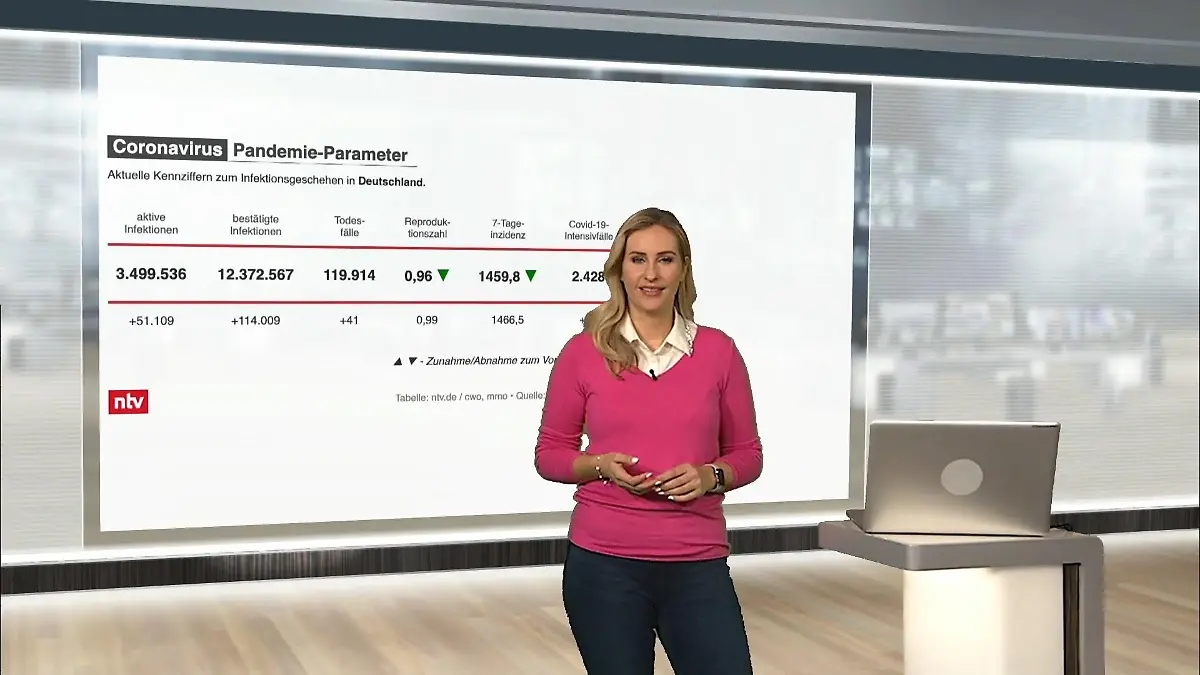 03:38
03:38Die aktuellen Corona-Zahlen für Deutschland
 04:12
04:12Erst BioNTech, dann Novavax?
 03:41
03:41Geimpft, Geboostert, Genesen: Wie lange bin ich geschützt?
 02:34
02:34Epidemiologe warnt vor „zu niedrigen Zahlen“
 03:35
03:35Neue Mutation in New Yorker Abwasser
 03:22
03:22Dr. Specht: Darum müssen neue Lockerungen kommen
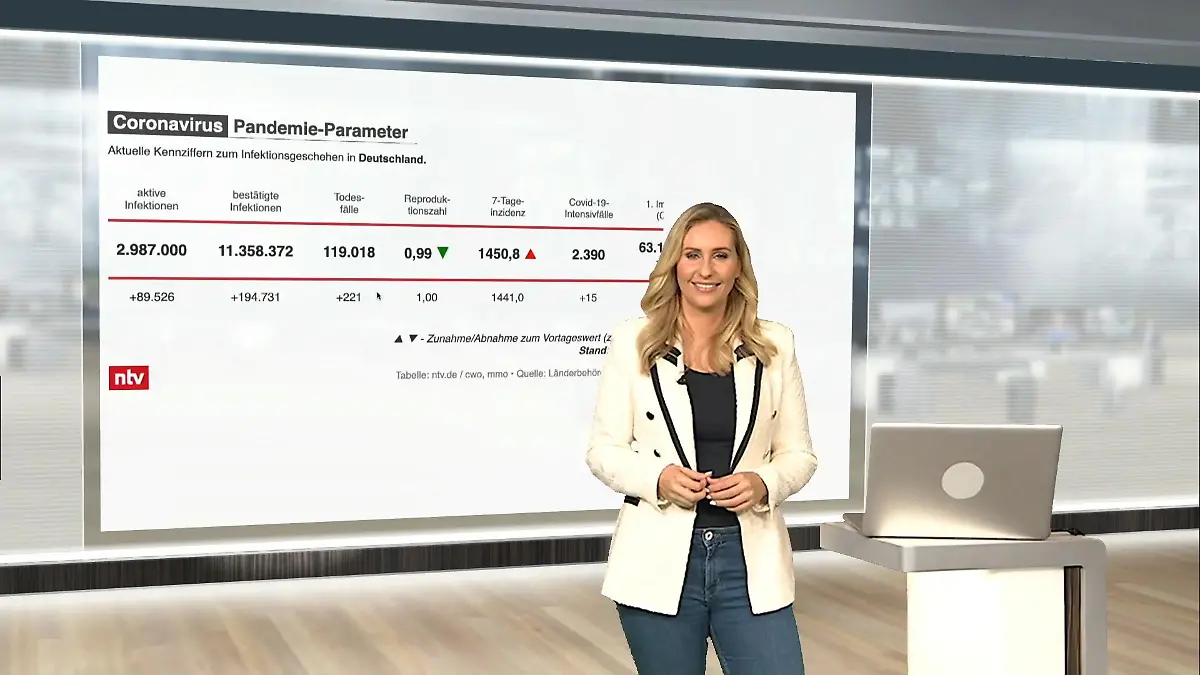 05:05
05:05Die aktuellen Corona-Zahlen für Deutschland
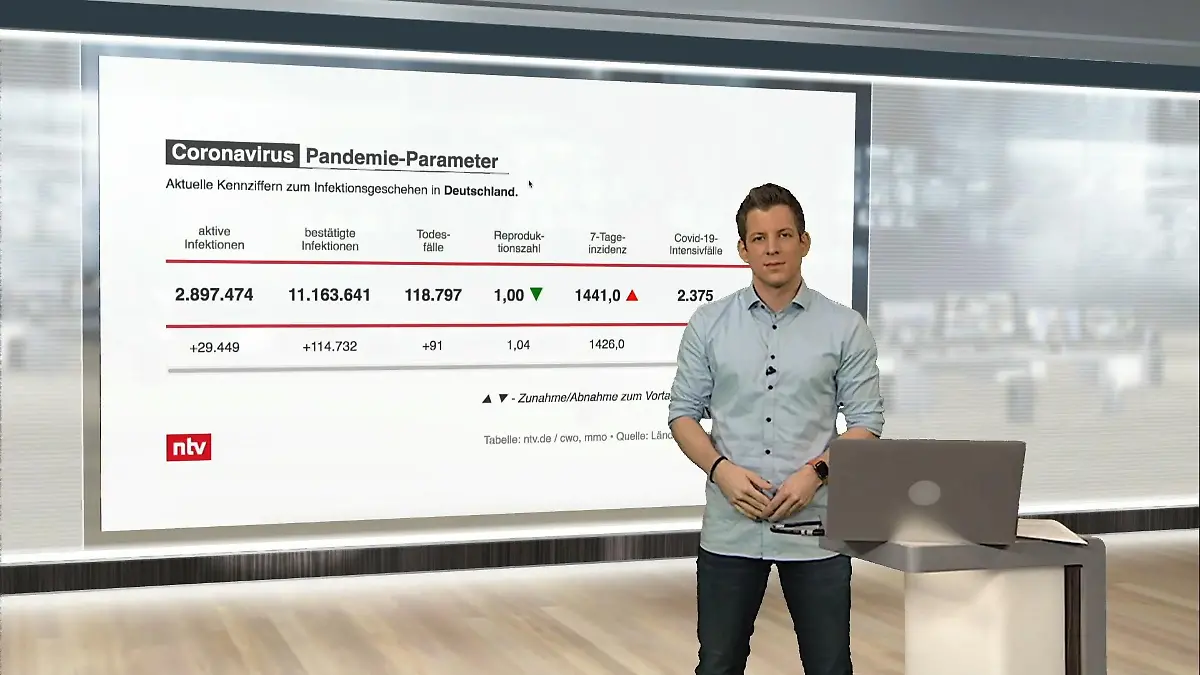 03:04
03:04Die aktuellen Corona-Zahlen für Deutschland
 04:58
04:58"Wir sind jetzt im absoluten Notprogramm"
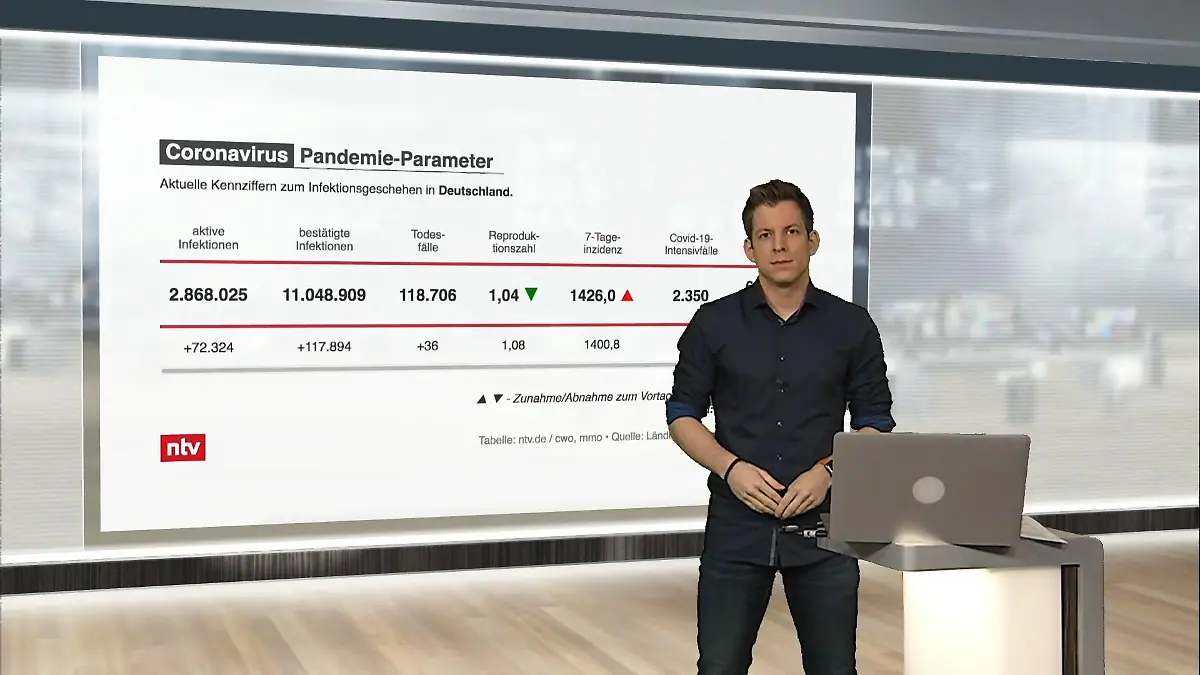 03:54
03:54Die aktuellen Corona-Zahlen für Deutschland
 04:25
04:25Jetzt impfen die Apotheken endlich auch
 01:50
01:50Erhöht sich mit Novavax die Impfquote?
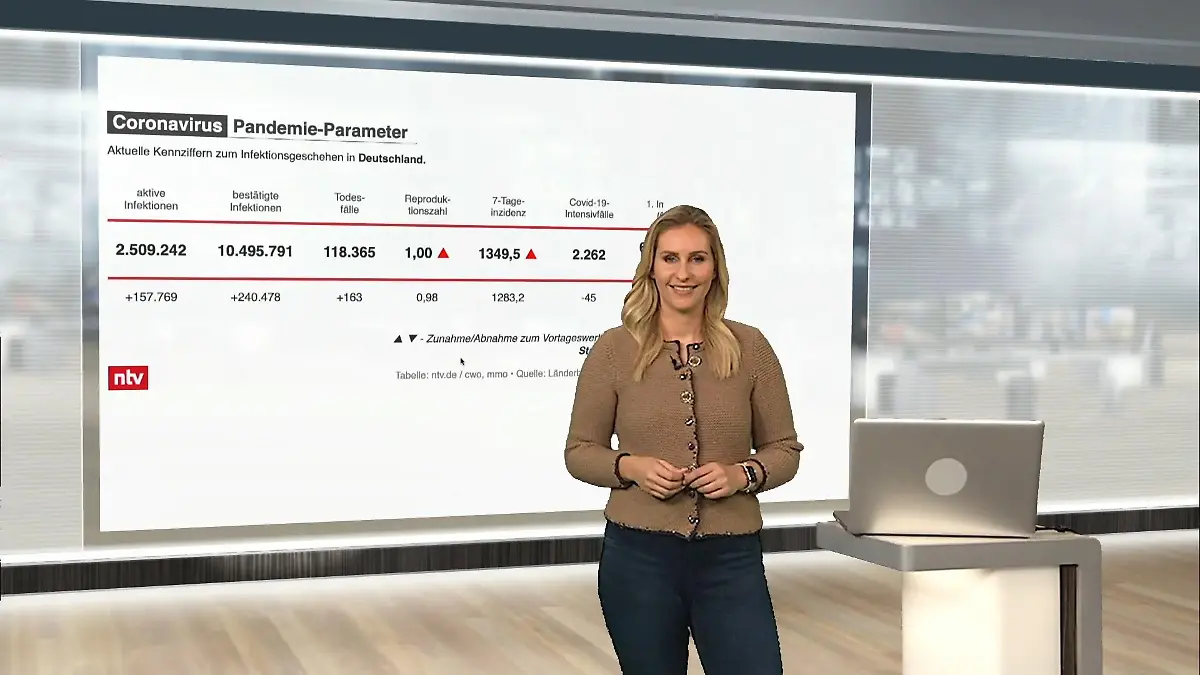 02:53
02:53Das sind die aktuellen Coronazahlen für Deutschland
 03:44
03:44Weniger ansteckend dank Booster? Epidemiologe klärt auf
 04:00
04:00Bald wieder Lockerungen bei Jüngeren?
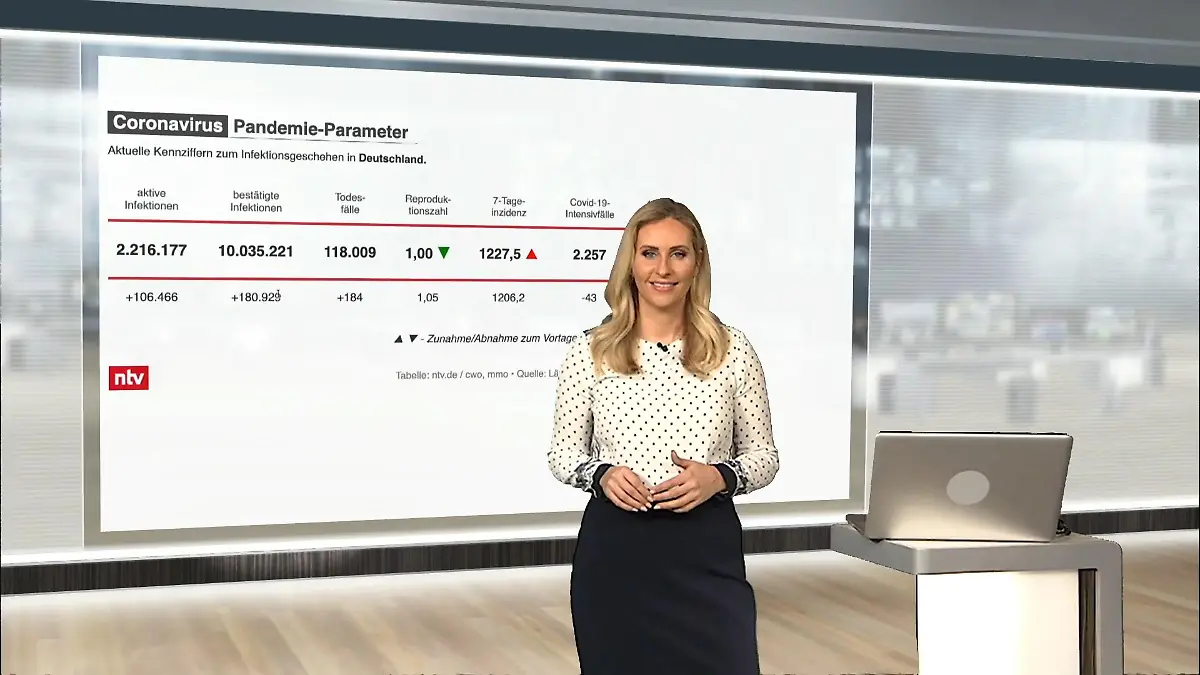 03:42
03:42Die aktuellen Corona-Zahlen für Deutschland
 03:15
03:15Intensivmediziner Janssens im Corona-Talk
 02:50
02:50EU-Impfnachweis nur noch 9 Monate ohne Booster gültig
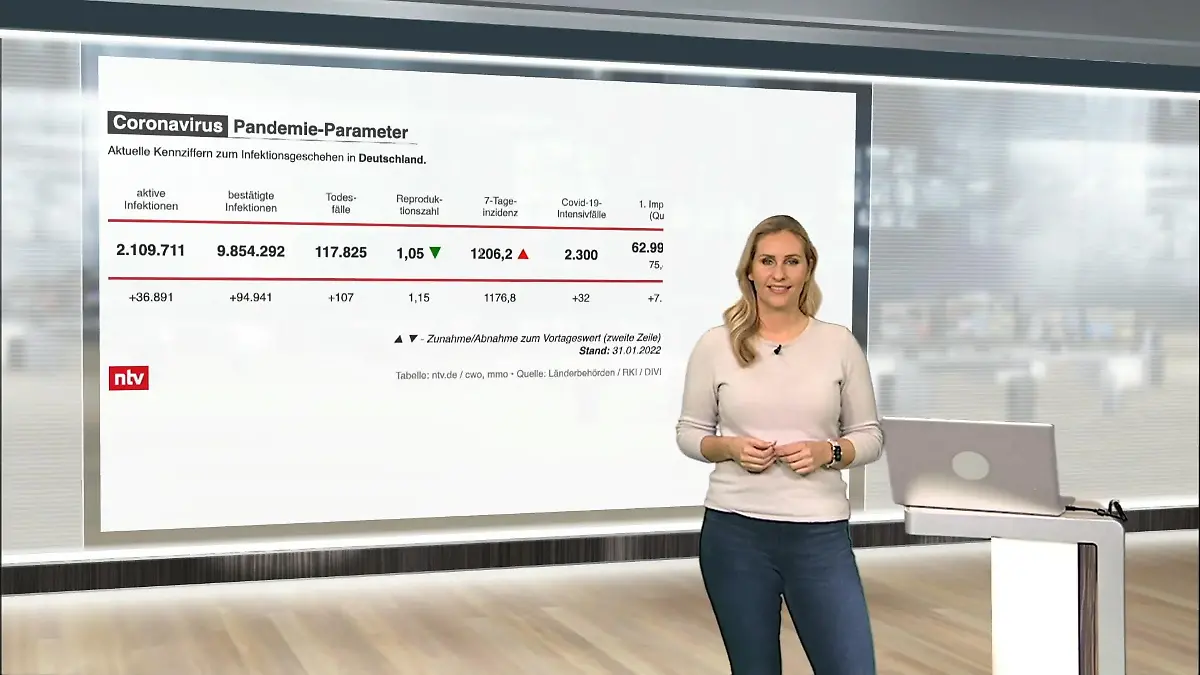 03:07
03:07Die aktuellen Corona-Zahlen für Deutschland
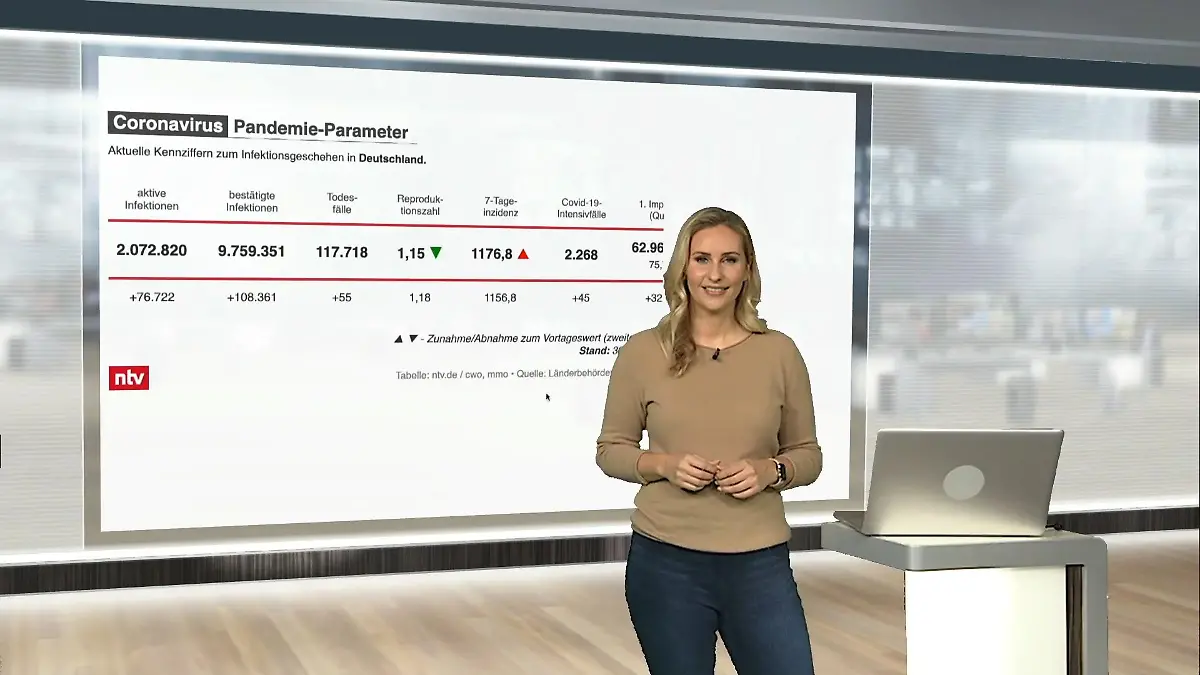 03:44
03:44Die aktuellen Corona-Zahlen für Deutschland
Zulassung auch in den USA beantragt
In den USA hat Pfizer gerade eine Notfallzulassung für Paxlovid beantragt. Nach Angaben des Unternehmens von Anfang November verhindert die Corona-Pille sehr erfolgreich schwere Krankheitsverläufe bei Hochrisikopatienten. Eine Zwischenanalyse von Testergebnissen ergab Pfizer zufolge, dass das Medikament das Risiko von Krankenhauseinweisungen und Todesfällen bei Covid-19-Patienten um 89 Prozent senke.
Zurzeit sind drei Medikamente zur Behandlung von Covid-Patienten in der EU zugelassen. Für vier weitere wurden Zulassungsanträge gestellt. (dpa)

